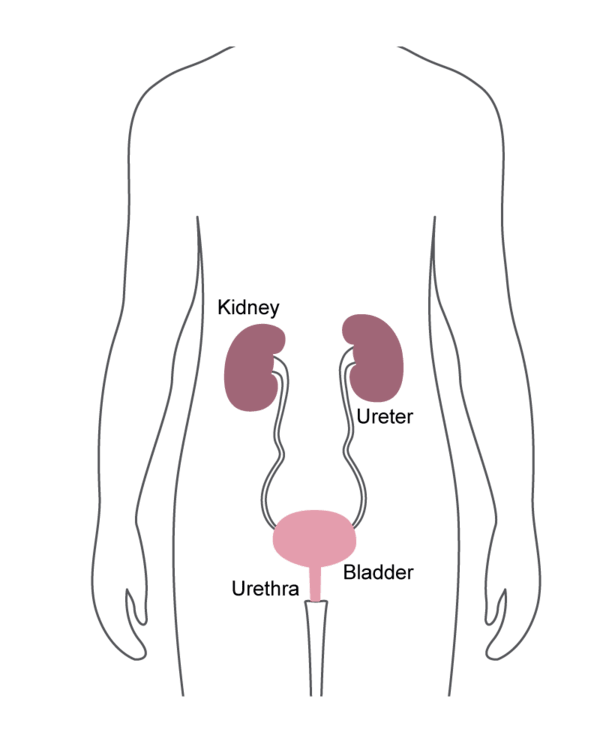
Alerta de Segurança FDA sobre Infecções Associadas a Endoscópios Urológicos Reprocessados
Em 1 de abril de 2021, a US Food and Drug Administration (FDA) emitiu um alerta de segurança em forma de uma carta para profissionais de saúde em relação a infecções associadas a endoscópios urológicos reprocessados. Neste anúncio, a FDA observa que recebeu vários Relatórios de Dispositivos Médicos (MDRs) que descrevem infecções de pacientes após o procedimento ou outros possíveis problemas de contaminação associados ao reprocessamento desses dispositivos.1
“Estamos muito preocupados com as três mortes relatadas—fora dos Estados Unidos—associadas a essas infecções e estamos agindo rapidamente para comunicar aos profissionais de saúde e ao público o que sabemos e o que ainda é um problema emergente.”2 --Jeff Shuren, MD, JD, diretor do Centro de Dispositivos e Saúde Radiológica da FDA.