Alerta de Seguridad de la FDA sobre Infecciones Relacionadas con Endoscopios Urológicos Reprocesados
El 1 de abril de 2021, la Food and Drug Administration de los EE. UU. (FDA) emitió una alerta de seguridad en forma de una carta a los proveedores de atención médica sobre infecciones relacionadas con endoscopios urológicos reprocesados. En este anuncio, la FDA señala que han recibido numerosos informes de dispositivos médicos (MDR) que describen infecciones de pacientes posteriores al procedimiento u otros posibles problemas de contaminación asociados con el reprocesamiento de estos dispositivos.1
“Estamos muy preocupados por las tres muertes reportadas, fuera de los Estados Unidos, asociadas con estas infecciones, y estamos actuando rápidamente para comunicarnos con los proveedores de atención médica y el público sobre lo que sabemos y lo que aún es un problema emergente”.2 -- Jeff Shuren, MD, JD, director del Centro de Dispositivos y Salud Radiológica de la FDA
¿Cuáles son los endoscopios en cuestión?
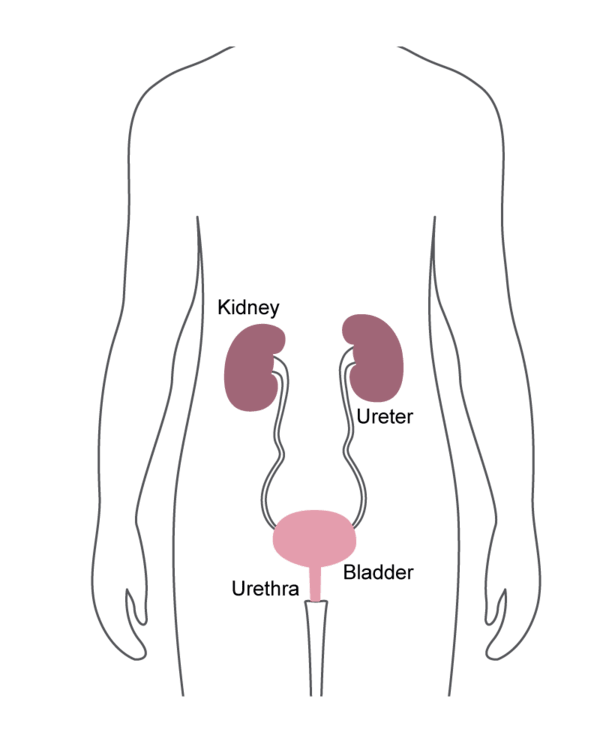
Usados para ver el tracto urinario de un paciente, los endoscopios señalados específicamente por la alerta de seguridad de la FDA son cistoscopios, ureteroscopios y cistouretroscopios. Estos son dispositivos clave en urología que permiten al médico visualizar y tratar áreas de interés.